|
| |||
|
Týdeník věnovaný aktualitám a novinkám z fyziky a astronomie. | |||
|
Nobelova cena za chemii aneb elektronová mikroskopie vrací úder
Lucie Kulhánková
Pokud jste nadšenými sledujícími Nobelových cenNobelova cena – je udílena švédskou Královskou akademií věd jednou ročně v pěti kategoriích: za fyziku, chemii, fyziologii a medicínu, literaturu a za úsilí o mír. Cena je hrazena z Nobelovy nadace, kterou založil Alfréd Nobel, vynálezce dynamitu, v roce 1895. První cena za fyziku byla udělena v roce 1901 Wilhelmu Roentgenovi za objev rentgenového záření. Hodnota Nobelovy ceny se mění, v roce 2021 činí 10 milionů švédských korun, tj. 25 milionů českých korun. Uděluje se vždy 10. prosince při výročí smrti Alfreda Nobela., možná víte, že jedna cena za elektronovou mikroskopii již udělena byla. V roce 1968 ji za fyziku získal Ernst Ruska za vynález elektronového mikroskopuElektronový mikroskop – mikroskop, který k zobrazení předmětů využívá vlnových vlastností svazku elektronů. Elektron se chová podobně jako světlo, jeho vlnová délka je ale výrazně kratší a tak je možné sledovat menší předměty než za pomoci světla. Elektronový mikroskop byl vynalezen v roce 1931 Ernstem Ruskou.. Letos byla udělena třem vědcům, kteří se podíleli na rozvoji této technologie a jejího „podoboru“ kryo-elektronové mikroskopie. To, že za tento typ zobrazování molekul byly uděleny již dvě Nobelovy ceny, naznačuje, o jak významný objev se jedná. A pokud jste stále na pochybách, stačí se podívat na statistiku databáze struktur PDBPDB – Protein Data Bank, databáze třírozměrných struktur proteinů i dalších molekul. Databáze byla založena v roce 1971 a data jsou především experimentálního původu – z rentgenové krystalografie, elektronové mikroskopie nebo jaderné magnetické rezonance.. Běžným světelným mikroskopem můžeme dosáhnout rozlišovací schopnosti do řádu mikrometrů. Lze tak pozorovat jednotlivé organely či buňky. Na větší rozlišení se musíme podívat po kratších vlnových délkách elektronů. Ty nám pak umožňují zobrazovat objekty s rozlišením až v řádu nanometrů. V těchto rozměrech se již pohybují například délky vazeb mezi jednotlivými atomy. Schopnost vidět molekuly a jejich struktury prostřednictvím elektronového mikroskopu posunulo biology a chemiky blíže k porozumění, proč a jak proteinyProteiny – bílkoviny, velké organické molekuly tvořené aminokyselinami uspořádanými do lineárních útvarů. Tyto dlouhé řetězce jsou pospojovány peptidovými vazbami (vazba karboxylové skupiny jedné molekuly a aminoskupiny druhé molekuly). a molekuly fungují. Od počátků elektronové mikroskopie jsme již rozluštili struktury proteinů, DNADNA – Deoxyribonucleic acid, deoxyribonukleová kyselina. Jde o nukleovou kyselinu, jejíž cukernou složkou je 2'-deoxyribóza. Báze jsou tvořeny především čtveřicí adenin, thymin, guanin a cytosin; vzájemně komplementární jsou nukleotidy s adeninem a thyminem, a nukleotidy s cytosinem a guaninem. DNA vytváří dvoušroubovici z navzájem komplementárních opačně orientovaných řetězců, pracovního a paměťového. Její hlavní funkcí je uchovávání genetické informace., RNARNA – Ribonucleic acid, ribonukleová kyselina. Jde o nukleovou kyselinu, jejiž cukernou složkou je ribóza, nukleotidy jsou obdobné jako v DNA, pouze báze thymin je nahrazena uracilem, který také umožňuje komplementaritu s adeninem. Hlavní funkcí RNA je přenos informace z DNA do dalších struktur. Na rozdíl od DNA dvoušroubovice není typickou strukturou RNA. i všelijakých komplexů, jako je například ribozomRibozomy – součásti buňky, struktura tvořená bílkovinami a ribonukleovými kyselinami. Sestávají z velké a malé podjednotky. Zajišťují vytváření peptidů a bílkovin z aminokyselin podle vzoru RNA, vzniklé přepisem z DNA. a spliceozomSpliceozom – velký buněčný komplex RNA a proteinů, který zodpovídá za sestřih nově vznikající RNA. V elektronovém mikroskopu má tvar elipsoidu.. Strukturní informace se stala zásadní částí výzkumu, protože nám dovoluje nahlédnout do nitra buněk a zkoumat vazby a dynamiku mezi jednotlivými součástmi.
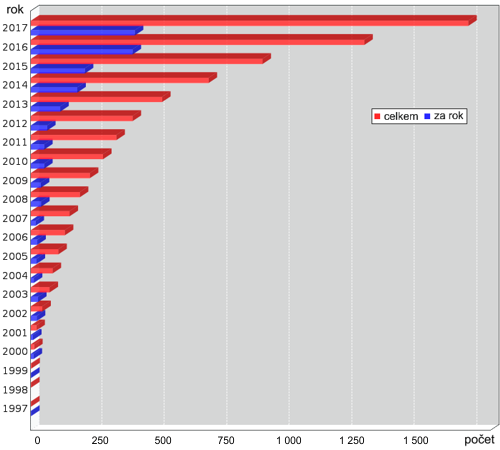
Nárůst počtu struktur popsaných pomocí elektronové mikroskopie v databázi
PDB (Protein Data Bank). Zdroj: RCSB.
|
Nobelova cena – je udílena švédskou Královskou akademií věd jednou ročně v pěti kategoriích: za fyziku, chemii, fyziologii a medicínu, literaturu a za úsilí o mír. Cena je hrazena z Nobelovy nadace, kterou založil Alfréd Nobel, vynálezce dynamitu, v roce 1895. První cena za fyziku byla udělena v roce 1901 Wilhelmu Roentgenovi za objev rentgenového záření. Hodnota Nobelovy ceny se mění, v roce 2021 činí 10 milionů švédských korun, tj. 25 milionů českých korun. Uděluje se vždy 10. prosince při výročí smrti Alfreda Nobela. Elektronový mikroskop – mikroskop, který k zobrazení předmětů využívá vlnových vlastností svazku elektronů. Elektron se chová podobně jako světlo, jeho vlnová délka je ale výrazně kratší a tak je možné sledovat menší předměty než za pomoci světla. Elektronový mikroskop byl vynalezen v roce 1931 Ernstem Ruskou. SEM – Skenovací Elektronová Mikroskopie, vytváření obrazu předmětu elektronovým mikroskopem z odražených elektronů. Energetický svazek elektronů skenuje povrch vzorku. Obraz tvořený odraženými elektrony je následně zvětšen a zaostřen elektronovou optikou a na stínítku převeden na viditelné záření, které je většinou dále zaznamenáváno CCD kamerou. Slouží zejména k metalografickým analýzám kovových či pokovených materiálů a chemické analýze jejich složení na základě spektrometrie charakteristického rentgenového záření buzeného dopadajícím elektronovým svazkem. Jinou technikou je TEM, při které se obraz vytváří z prošlých elektronů. TEM – transmisní elektronová mikroskopie, vytváření obrazu tenkého předmětu (cca do 100 nm tloušťky) průchodem energetických elektronů. Obraz tvořený prošlými elektrony je následně zvětšen a zaostřen elektronovou optikou a na stínítku převeden na viditelné záření, které je většinou dále zaznamenáváno CCD kamerou. Pokud je vzorek touto technikou skenován, hovoříme o skenovací transmisní elektronové mikroskopii (STEM). Jinou technikou je SEM, při které se obraz vytváří z odražených elektronů. |
Jak vlastně taková elektronová mikroskopie funguje?
V základním rozdělení rozlišujeme dva typy elektronových mikroskopů: skenovací (SEMSEM – Skenovací Elektronová Mikroskopie, vytváření obrazu předmětu elektronovým mikroskopem z odražených elektronů. Energetický svazek elektronů skenuje povrch vzorku. Obraz tvořený odraženými elektrony je následně zvětšen a zaostřen elektronovou optikou a na stínítku převeden na viditelné záření, které je většinou dále zaznamenáváno CCD kamerou. Slouží zejména k metalografickým analýzám kovových či pokovených materiálů a chemické analýze jejich složení na základě spektrometrie charakteristického rentgenového záření buzeného dopadajícím elektronovým svazkem. Jinou technikou je TEM, při které se obraz vytváří z prošlých elektronů.) a transmisní (TEMTEM – transmisní elektronová mikroskopie, vytváření obrazu tenkého předmětu (cca do 100 nm tloušťky) průchodem energetických elektronů. Obraz tvořený prošlými elektrony je následně zvětšen a zaostřen elektronovou optikou a na stínítku převeden na viditelné záření, které je většinou dále zaznamenáváno CCD kamerou. Pokud je vzorek touto technikou skenován, hovoříme o skenovací transmisní elektronové mikroskopii (STEM). Jinou technikou je SEM, při které se obraz vytváří z odražených elektronů.). Již podle názvu můžeme odhadnout jejich funkci. Skenovací mikroskop používá zpravidla větší vzorky potažené kovovou vrstvou a skenuje jejich povrch. Transmisní mikroskop funguje obdobně jako mikroskop světelný a vzorek musí být natolik tenký, aby jím elektronový paprsek prostoupil (maximálně 100 nm). Samozřejmě rozdíl najdeme v samotné stavbě mikroskopu. Jako zdroj elektronů slouží nejčastěji wolframová katoda a místo čoček zde najdeme elektromagnety. Při průchodu vzorkem jsou elektrony vychýleny ze své dráhy atomy vzorku. Takto odchýlené elektrony jsou zachyceny clonou. Zbytek paprsku pak putuje na detektor, kde je zachycen. Následně lze pomocí výsledného obrazu zrekonstruovat původní objekt. V případě skenovacího mikroskopu naopak detekujeme takto odražené elektrony (sekundární a zpětně odražené).
Před příchodem kryo-elektronové mikroskopie se molekuly zobrazovaly (a stále nejčastěji zobrazují) pomocí rentgenové krystalografie, kdy se vzorky připravují krystalizací sledovaných molekul. Právě krystalizace biologických materiálů je často velmi obtížná. Neexistuje žádný postup či příručka, která by pomohla objasnit podmínky, při kterých daná molekula či komplex bude krystalizovat. Často se tedy zkouší různorodé podmínky, dokud se krystalizace nepodaří. To je obzvláště problematické u komplexů nebo proteinů, které jsou méně uspořádané a jejich krystalizace je tak obecně složitá. I pokud získáme krystal, každý si asi dovede představit, že přirozené prostředí v nitru buňky není nikterak podobné krystalové mřížce. Pro pozorování molekul blíže přirozenému stavu se proto stále více využívá kryo-elektronové mikroskopie nebo nukleární magnetické rezonance (NMRNMR (nukleární magnetická rezonance) – magnetická spinová rezonance na spinech neutronů a protonů atomových jader. Rezonanční frekvence je úměrná vnějšímu magnetickému poli s koeficientem úměrnosti 0,76 kHz/T. ). Využití rychlého zmražení pro přípravu preparátů se proto přímo nabízí. Vzorek se zamrazí při extrémně nízké teplotě, a tak nemá čas se poškodit nebo degradovat.
Samozřejmě se ani tomuto typu zobrazení nevyhnou různé nešvary. Při bombardování vzorku svazkem elektronů dochází k jeho rychlému znehodnocení. V počátcích proto bylo nutné používat slabší elektronový svazek. Na obrázku můžete porovnat první strukturu bakteriorhodopsinu získanou letošním laureátem Richardem Hendersonem v roce 1975 a sturkturu, kterou získal o patnáct let později v roce 1990. Pozdější strukturou Henderson prolomil nanometrovou škálu . Dokázal tak, že kryo-elektronová mikroskopie může konkurovat rentgenové krystalografii. Henderson byl schopen takto zobrazit bakteriorhospsin s využitím podobných matematických postupů jako při rentgenové krystalografii. To bylo možné proto, že bacteriorhodopsin je membránový protein, a tak má většina molekul stejnou či podobnou orientaci.
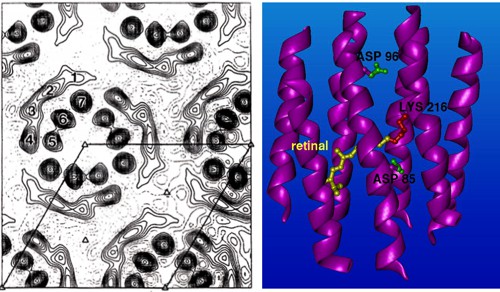
Struktura bakteriorhodopsinu v roce 1975 a v roce 1990. Zdroj: R. Henderson.
Dalším úkolem kryo-elektronové mikroskopie proto bylo zobrazení molekul v roztoku. Jak získat obraz molekuly, která se vyskytuje ve vzorku v mnoha kopiích v rozličných orientacích? Na tuto otázku odpověděl Joachim Frank, druhý letošní laureát. Frank využil různých úhlů, ve kterých se daná molekula vyskytuje při detekci. Vyvinul pak matematickou metodu, která oddělí jednotlivé proteinové zobrazení od pozadí, seskupí je podle podobnosti a jejich průměrný obraz zkombinuje do trojrozměrného obrazu původního objektu.
Třetí zásadní oblastí pro rozvoj kryo-elektronové mikroskopie je pak samotná příprava vzorků. Díky tomu, že celý vnitřek mikroskopu je ve vakuu, dochází k odpařování vody. Henderson při svých pokusech používal roztok sacharózy, aby zabránil vyschnutí vzorků. Tento postup lze však použít pouze pro membránové proteiny. Jacques Dubochet přišel s použitím procesu vitrifikace. Dubochet chtěl předejít tvorbě krystalů vody zamražením vzorků tak rychle, že se vytvoří skelná vrstva namísto krystalů. Toho lze dosáhnout rychlým mražením v tekutém dusíku, který má teplotu –196 stupňů Celsia. Díky vitrifikaci se příprava vzorků enormně zrychlila a zefektivnila.
Díky kryo-elektronové mikroskopii dnes můžeme pozorovat molekuly v různých stádiích jejich dynamiky. Při rychlém zmražení můžeme zobrazit naše vzorky „v akci“ a podívat se na několik stádií rozličných reakcí a poodkrýt tak dynamiku mezi jednotlivými buněčnými komponentami. Můžeme zobeazit struktury celých virů či malých proteinů v rozlišení detailnějším než 10–10 m. Každým rokem se tyto metody posouvají k lepšímu a lepšímu rozlišení a do budoucnosti snad můžeme doufat v až rutinní sledování tvorby molekulárních struktur.
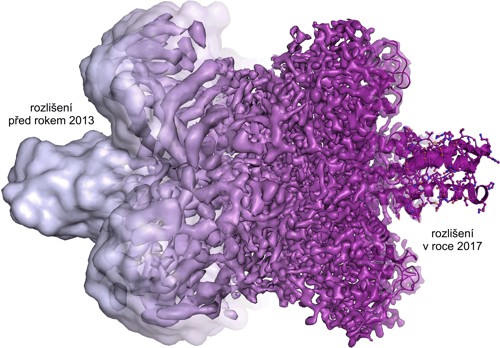
Vývoj rozlišení v posledních letech. Zdroj: Martin Högbom,
The Royal Swedish Academy of Sciences.
Jacques Dubochet (*1942)

Jacques Dubochet (*1942)
Jacques Dubochet je švýcarský biofyzik narozený v roce 1942 ve městě Aigle. V roce 1962 získal vysokoškolské vzdělání ve fyzice na polytechnologické univerzitě v Lausanne. K elektronové mikroskopii se dostal až po roce 1969, kdy získal certifikát v molekulární biologii na Ženevské univerzitě. Na stejné univerzitě o několik let později v roce 1973 obhájil diplomovou práci v oboru biofyzika. Jeho kariéra poté pokračovala v Evropské laboratoři molekulární biologie (EMBL) v Heidelbergu. Na EMBL pracoval jeho vedoucí výzkumné skupiny mezi lety 1978 a 1987. Na svoji mateřskou univerzitu v Lausanne se vrátil jako profesor v roce 1987 a působil zde až do odchodu do důchodu v roce 2007. Za svoji kariéru získal v roce 2014 cenu Lennarta Philipsona udělovanou v EMBL. V roce 2017 získal Nobelovu cenu za chemii za vyvinutí technologií pro kryo-elektronovou mikroskopii, která umožňuje určení struktury biomolekul v roztoku. Jeho hlavním přínosem byla nová metoda přípravy vzorků – vitrifikace (jejich prudké ochlazení kapalným dusíkem, při němž nedojde ke krystalizaci, ale zesklovatění).
Richard Henderson (*1945)

Richard Henderson (*1945)
Richard Henderson se narodil v roce 1945 ve skotském Edinburghu. Do svých 21 let studoval fyziku na Edinburghské Univerzitě. Následně se rozhodl přejít k molekulární biologii. Jako student pracoval v Laboratoři molekulární biologie v Cambridgi na struktuře chymotripsinu zobrazované pomocí rentgenové krystalografie. V postgraduálním studiu na Yaleově univerzitě se začal věnovat membránovým proteinům. Po návratu do Cambridge v roce 1973 začal společně s Nigelem Unwinem pracovat na elektronovém mikroskopu jako cestě pro zobrazování proteinů. Na této technologii pracoval dalších patnáct let. Mezi lety 1986 a 2001 byl i vedoucím oddělení Strukturní biologie a vedoucím celé Laboratoře molekulární biologie mezi lety 1996 a 2006. V roce 2009 začal pracovat elektronovou mikroskopií jediné molekuly, která je nyní možná díky stále se zlepšujícím technickým parametrům elektronových mikroskopů. Ve své vědecké kariéře získal mnoho ocenění, mezi nimi i cenu Ernsta Rusky za elektronovou mikroskopii (1981), cenu Lewise Rosenstiela (1991) nebo cenu Alexandera Hollaendera za biofyziku (2016). V roce 2017 získal Nobelovu cenu za chemii za přínos ke kryo-elektronové mikroskopii, která umožňuje určení struktury biomolekul v roztoku.
Joachim Frank (*1940)

Joachim Frank (*1940)
Joachim Frank je německý profesor biochemie a molekulární biofyziky. Frank se narodil v roce 1940 v Siegenu. V roce 1963 získal Vordiplom (obdoba bakalářského titulu) ve fyzice na univerzitě ve Freiburgu. Následně ve svých studiích pokračoval na Mnichovské univerzitě. Doktorát získal na Max-Planckově institutu v Mnichově. V rámci postgraduálního studia odjel do Ameriky a pracoval na Caltechu, Kalifornské univerzitě a Berkelejské univerzitě. Po krátkém návratu do Max-Planck institutu v roce 1972 začal pracovat v Cambridgi. Ani tam však dlouho nepobyl a již v roce 1975 přešel do Wadsworthova centra v New Yorku, kde se zabýval jednočásticovou elektronovou mikroskopii. V roce 1986 byl jmenován profesorem. V rámci sabatikalu odjel do Evropy a pracoval s Richardem Hendersonem. Momentálně působí na Kolumbijské univerzitě jako profesor biochemie a molekulární biofyziky. Je autrem metody pro 3D analýzu molekulárních struktur. V roce 2017 získal Nobelovu cenu za chemii za přínos ke kryo-elektronové mikroskopii, která umožňuje určení struktury biomolekul v roztoku.
Odkazy
- Nobel Prize server: Nobel Prices in Chemistry
- PDB: Yearly Growth of Structures Solved By Electron Microscopy
- Nobel Prize server: Dubochet's Vitrification Method
- Nobel Prize server: Frank's Image Analysis nfor 3D Image Structures
- Nobel Prize server – Nobel media: The Nobel Prize in Physics 2017 – Scientific Background: The development of cryo-electron microscopy; 13 Oct 2017
- M. Beck, W. Baumeister: Cryo-electron tomography: can it reveal the molecular sociology of cells in atomic detail?; Trends Cell Biol. 26 (2016) 825-837
-
J.
Dubochet et al.: Cryo-electron microscopy of
vitrified specimens;
Q. Rev. Biophys. 21 (1988) 129–228 - J. Dubochet, A. W. McDowall: Vitrification of pure water for electron microscopy; J. Microsc. 124 (1981) 3–4
- J. Frank, M. van Heel: Correspondence analysis of aligned images of biological particles; J. Mol. Biol. 161 (1982) 134–137
- R. Henderson, P. N. T. Unwin: Three-dimensional model of purple membrane obtained by electron microscopy; Nature 257 (1975) 28–32
-
R.
Henderson et al.: Model for the structure of
bacteriorhodopsin based on high-resolution electron cryo-microscopy;
J. Mol. Biol. 213 (1990) 899–929 -
M.
van Heel, J. Frank: Use of multivariates statistics
in analysing the images of biological macromolecules;
Ultramicroscopy 6 (1981) 187–194
